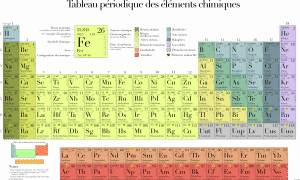
La tabla periodica de los elementos es la clasificación de los elementos químicos ordenados por su número atómico.
Cada elemento químico se caracteriza por el número de protones de los núcleos de sus átomos, denominado también número atómico; así, el primer elemento de la tabla es el hidrógeno, que sólo tiene un protón.
Protón a protón va apareciendo un elemento químico distinto.
Las propiedades químicas de una sustancia dependen del número de electrones de sus átomos, pero como los átomos son neutros, ese número coincide con el de protones del núcleo.
Como explica la mecánica cuántica, la teoría física que describe las leyes de la física a escala atómica, los electrones van llenando alrededor del núcleo una serie de capas, en las que sólo puede haber un determinado número de electrones. Las propiedades de cada elemento dependen de que sus átomos tengan o no capas vacías, y de cuántos electrones falten para llenarlas, o, dicho de otra forma, de su configuración electrónica.
Una consecuencia de esto es que, a medida que va subiendo el número atómico, las propiedades químicas de los elementos se van pareciendo a intervalos regulares; de ahí que la tabla se llame «periódica».
Estas regularidades se manifiestan en la tabla disponiéndola en columnas de manera que los elementos de una misma columna tengan propiedades similares; se forman así grupos de elementos: halógenos, gases nobles, metales alcalinos, metales alcalinotérreos, elementos de transición, etc.
La tabla se creó antes de que se pudiera explicarla, antes de la formulación de la teoría cuántica y antes incluso del descubrimiento del electrón. Fue el fruto de una serie de desarrollos científicos basados en la clasificación empírica de las propiedades de las sustancias químicas, pero se suele dar una fecha exacta a su nacimiento: el 17 de febrero de 1867, el día que Dimitri Ivanovich Mendeleiev terminaba la primera de sus numerosas tablas. Sólo había en ella 63 elementos, y tenía huecos.
A partir de la periodicidad de las propiedades Mendeleiev predijo con éxito -como se iría viendo- las propiedades de elementos que aún no se habían descubierto en su época (pero no la existencia de los gases nobles, que empezarían a descubrirse en 1894 y que costó mucho añadir a la tabla), y se atrevió incluso a modificar los pesos atómicos medidos de algunos de los ya conocidos.
El mayor mérito de Mendeleiev fue, seguramente, haber descubierto la periodicidad de la tabla y haberla elevado a ley de la naturaleza, aun cuando no conociese el porqué de su existencia. Pero antes de él había habido ya muchos intentos de ordenar los elementos.
En 1787 Lavoisier, con Fourcroy, Guyon de Morveau y Berthollet, ordenó los 33 elementos que por entonces se conocían, pero lo hizo linealmente, no en una tabla bidimensional con una regularidad.
Johann Döbereiner, en 1817, fue de los primeros en intentar hacer esto: descubrió que muchos elementos podían ordenarse en grupos de tres por la similitud de sus propiedades.
Peter Kremers quiso continuar con la ordenación por tríos, que Dumas abandonó en 1857 en favor de una clasificación basada en el peso atómico. Actualmente sabemos que no es el peso, sino la masa atómicala propiedad clave (hoy se sabe que en aquél entran también los neutrones del núcleo), pero en la compleja tabla helicoidal de Béguyer de Chancourtois de 1862, basada en el peso atómico, ya se manifestaba una periodicidad.
John Newlands descubrió una correlación en los saltos de ocho elementos. Su tabla fue ridiculizada, pero antes de ella nunca se habían clasificado los elementos con números ordinales.
Por fin, Julius Lothar Mayer, de Breslau, elaboró en 1868 una tabla muy parecida a la de Mendeleiev del año siguiente, pero, al contrario que éste, no colocó bien todos los elementos.
La adopción del número atómico (expresión acuñada por Rutherford, el descubridor del núcleo atómico, en 1920) como criterio de clasificación se debe al teórico Van de Broek, que la propuso en 1913, y Moseley, que comprobó la idea experimentalmente poco después.
La explicación de la periodicidad a partir de las capas de electrones parte de J.J. Thomson, el descubridor del electrón, quien enunció un rudimento de la idea en 1904; el paso fundamental lo da en 1913 Niels Bohr con su modelo cuántico del átomo, y remata la explicación el principio de exclusión de Wolfgang Pauli, de 1924. Estas ideas se integran en la mecánica cuántica de Heisenberg y Schrödinger, apenas posterior, que, aunque da un marco conceptual a la tabla, no permite en realidad calcularla de manera exacta por culpa de la complejidad de las funciones de onda de los átomos con muchos electrones.
No ha habido después grandes novedades: la tabla tridimensional de Dufour o la piramidal de Jensen, que manifiestan mejor la simetría de la tabla, o algunas tablas periódicas de ciertos tipos de moléculas.
Tabla periodicas para descargar:
Tabla periodicas en PDF:
[pdfviewer width=»700px» height=»550px» beta=»true/false»]https://www.deberes.net/wp-content/uploads/2015/04/tabla-periodica-en-pdf-para-imprimir.pdf[/pdfviewer]
[pdfviewer width=»700px» height=»550px» beta=»true/false»]https://www.deberes.net/wp-content/uploads/2015/04/tablas-periodicas-completas.pdf[/pdfviewer]
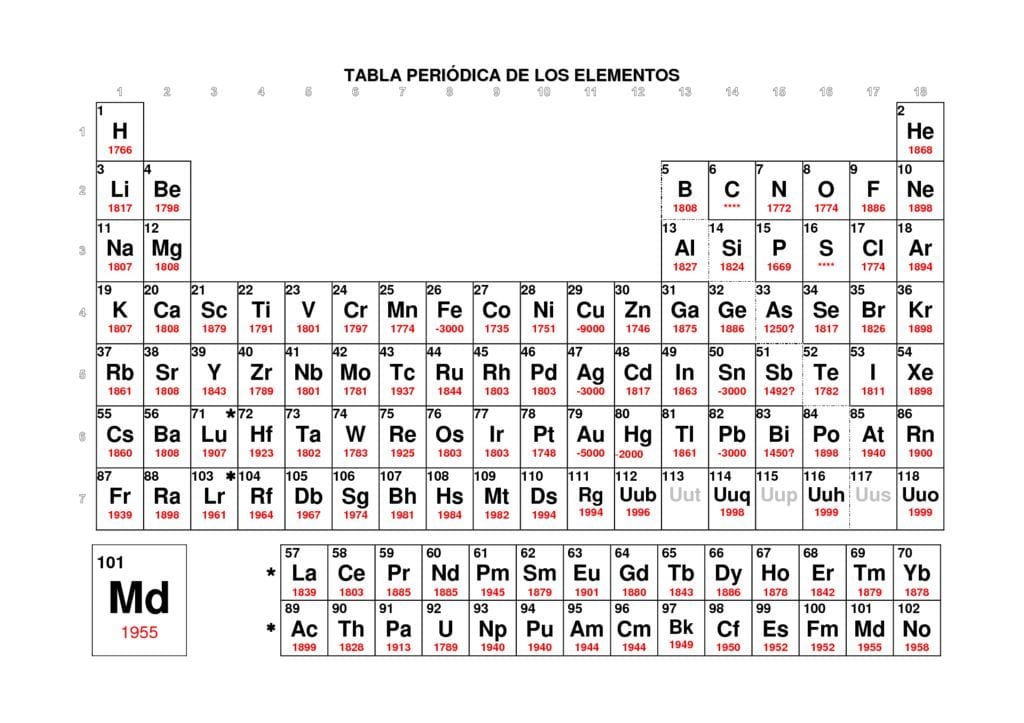
Tablas periodicas completas. 16 tablas periodicas en PDF: Normal, CONFIGURACIONES ELECTRÓNICAS, ELECTRONEGATIVIDADES, por estado a ESTADO A 298 K, VALENCIAS, NÚMEROS DE OXIDACIÓN, NOMBRE DE LOS GRUPOS, SISTEMA PERIÓDICO DE LOS ELEMENTOS por GRUPOS,…
Inicialmente, los elementos se clasificaron entre metálicos y no metálicos, pero los químicos eran incapaces de dividir estas categorías en grupos menores. Intentaron clasificarlos de otras maneras, por ejemplo, entre ácidos y bases, o según la valencia u otras propiedades. Sin embargo, la aplicación de estos sistemas resultaba ineficaz, puesto que muchos elementos podían clasificarse en más de una categoría. Finalmente se consiguió una clasificación mucho más detallada y útil que se basaba, en un principio, en el peso atómico de los elementos y, más adelante, en el número atómico. Esta clasificación configura lo que hoy conocemos como el sistema periódico, que se resume en la tabla periódica y muestra gráficamente las relaciones entre los distintos elementos.
Sistema periódico
Además de la división de los elementos conocidos entre metales y no metales, se desarrollaron otras distinciones en base a la reactividad de los elementos. Los elementos que presentaban propiedades intermedias entre los metales y los no metales pasaron a ser designados metaloides.
En 1828 el químico alemán J.W. Döbereiner advirtió que algunos elementos mostraban la misma diferencia de peso atómico (actualmente se usa el término masa atómica relativa) cuando se unían en grupos de tres. Observó, por ejemplo, las mismas diferencias de peso atómico entre el cloro y el bromo, y entre el bromo y el yodo. Basándose en el mismo principio agrupó otros elementos según su comportamiento, los cuales se conocen como las “tríadas de Döbereiner”. Estas clasificaciones fueron tomadas por el químico inglés John Newlands en 1864, que elaboró un esquema más general en el que ordenó los elementos según sus masas atómicas; al observar que los elementos con propiedades similares aparecían en intervalos regulares, subdividió la lista en columnas.
Newlands observó que las propiedades de los siete primeros elementos se repetían en los siete siguientes, de modo que el primero y el octavo, el segundo y el noveno, etc., pertenecían al mismo grupo o familia. A esta peculiaridad la llamó “ley de las octavas”. Los gases nobles, que no fueron descubiertos hasta la década de 1890, encajaban en este esquema al final de cada fila de elementos. Esta teoría no fue tomada en serio en la época, en gran parte debido al hecho de que Newland utilizara el término musical “octava”.
Basándose en las ideas de Newlands, el químico ruso Dmitry Mendeleyev desarrolló, en 1869, la ley periódica. Esta ley se basa en la hipótesis de que las propiedades de los elementos están sistemáticamente relacionadas con sus masas atómicas relativas. Distribuyó los elementos en una tabla, dejando espacios libres donde no había ningún elemento conocido con una masa atómica o unas propiedades físicas o químicas que ocupara tal posición. Los ocho primeros elementos tras el hidrógeno y el helio son litio, berilio, boro, carbono, nitrógeno, oxígeno, flúor y neón, los cuales (con excepción del neón, que aún no se había descubierto), dispuso en la primera línea, o período, de la tabla periódica. Los demás elementos conocidos los ordenó debajo de éstos según sus masas atómicas, formando un modelo de columnas de elementos, o grupos con propiedades similares.
Mendeleyev también ordenó lo que actualmente conocemos como los metales de transición en largos períodos separados de la sección de la tabla ocupada por los no metales.
La decisión de Mendeleyev de dejar espacios libres en la tabla fue ampliamente justificada por el posterior descubrimiento de elementos cuyas propiedades él había anticipado. Por ejemplo, predijo el descubrimiento de un elemento al que él llamaba eka-aluminio, subrayando sus propiedades mediante un estudio de las tendencias y similitudes dentro de los grupos de la tabla. Cuatro años después, se descubrió el galio, el cual presentaba las propiedades que él había predicho.
La tabla periódica constituye la mayor aportación hecha hacia el estudio de la química inorgánica. Contribuyó a determinar las estimaciones de las masas atómicas relativas auténticas, así como al descubrimiento de nuevos elementos. Sin embargo, un estudio del sistema periódico basado en la masa atómica plantea una serie de problemas; por ejemplo, el argón y el potasio, el yodo y el telurio, el cobalto y el níquel, a juzgar por sus propiedades y comportamiento, se situarían incorrectamente si se dispusieran en relación a sus masas atómicas. Durante mucho tiempo, esta anomalía permaneció sin resolver, pero actualmente se sabe que el número atómico de un elemento tiene más importancia que su masa atómica. Por ello, dichas anomalías de la tabla desaparecen cuando los elementos se ordenan según sus números atómicos.